乙醇,俗称酒精,是高中化学有机化学部分的核心物质之一。其性质的学习,不仅涉及醇类的通性,也常与其他官能团化合物结合进行综合考查。哌啶乙醇(或称N-羟乙基哌啶)作为一种含氮杂环的醇类衍生物,是检验学生对官能团性质迁移和应用能力的典型例子。以下将通过几道典型试题,系统梳理乙醇的核心性质,并探讨哌啶乙醇相关的考点。
一、 乙醇的核心性质回顾
乙醇的化学性质主要由其官能团羟基(-OH)决定,同时受乙基影响。主要反应包括:
1. 与活泼金属反应:如与钠反应生成乙醇钠和氢气。
> 2CH₃CH₂OH + 2Na → 2CH₃CH₂ONa + H₂↑
- 氧化反应:
- 燃烧:发出淡蓝色火焰,完全生成CO₂和H₂O。
- 催化氧化:在铜或银催化下生成乙醛。
- 被强氧化剂(如酸性K₂Cr₂O₇溶液)直接氧化为乙酸。
- 酯化反应:与羧酸在浓硫酸催化下生成酯和水。
- 脱水反应:
- 分子内脱水(消去反应):浓硫酸、170℃条件下生成乙烯。
- 分子间脱水:浓硫酸、140℃条件下生成乙醚。
- 取代反应:与氢卤酸(如HBr)反应生成溴乙烷。
二、 典型试题解析(涉及乙醇)
试题1:下列有关乙醇的说法错误的是( )
A. 可用作燃料,是一种可再生能源
B. 能与金属钠反应,反应时O-H键断裂
C. 与乙酸发生酯化反应时,乙醇分子中脱去氢原子
D. 在铜催化下与氧气反应,乙醇被还原为乙醛
答案与解析:D
A正确,乙醇是可再生能源。B正确,乙醇与钠反应的本质是羟基中的O-H键断裂,氢原子被取代。C正确,酯化反应的机理是“酸脱羟基醇脱氢”。D错误,在铜催化下与氧气反应是氧化反应,乙醇被氧化为乙醛。
试题2:写出乙醇在浓硫酸作用下,加热至170℃时发生反应的化学方程式,并指出反应类型。
答案与解析:
CH₃CH₂OH →(浓H₂SO₄, 170℃) CH₂=CH₂↑ + H₂O
反应类型:消去反应(或分子内脱水反应)。
三、 哌啶乙醇的性质与试题分析
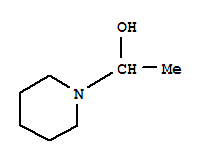
哌啶乙醇,结构简式可表示为C₅H₁₀N-CH₂CH₂-OH(哌啶环为六元含氮饱和杂环)。它同时具有哌啶(仲胺)的碱性和乙醇(伯醇)的羟基性质。考查时通常侧重官能团的独立性与相互影响。
核心性质推断:
1. 醇羟基的性质:能与Na反应放出H₂;能被氧化(如催化氧化生成对应的醛);能发生酯化、取代等反应。
2. 哌啶环的碱性:氮原子上有孤对电子,能与酸反应生成盐,使其具有碱性。
3. 综合影响:碱性氮原子的存在可能对邻近羟基的酸性或反应活性产生一定影响,但在高中阶段通常不深入讨论,主要要求识别官能团。
试题示例:
已知哌啶乙醇的结构如图所示(略,文本描述:一个六元环,其中一个CH₂被N原子取代,环上连接一个-CH₂CH₂OH基团)。下列叙述正确的是( )
A. 分子式为C₆H₁₅NO
B. 可以使酸性高锰酸钾溶液褪色
C. 与乙酸发生的酯化反应与乙醇类似
D. 其碱性比苯胺(C₆H₅NH₂)弱
答案与解析:C
A错误,正确分子式应为C₇H₁₅NO(哌啶环C₅H₁₀N,加上-CH₂CH₂OH为C₂H₅O)。B不一定正确,醇羟基通常不能使酸性高锰酸钾溶液直接褪色(除非被氧化),而饱和的哌啶环本身不能被高锰酸钾氧化,因此该物质可能不使酸性高锰酸钾褪色(具体需看条件)。C正确,因其含有醇羟基,可以与乙酸发生酯化反应,机理相同。D错误,哌啶为饱和脂肪仲胺,碱性通常强于苯胺(芳香胺,氮孤对电子与苯环共轭,碱性减弱)。
四、 学习建议与
- 夯实基础:熟练掌握乙醇的“五大反应”(与Na、氧化、酯化、两种脱水、与HX取代),这是分析所有醇类衍生物的基石。
- 官能团思维:面对如哌啶乙醇这类复杂分子,要立刻拆解出独立的官能团(如-OH、胺基),并分别回忆其典型性质。
- 注意综合与比较:当分子中存在多个官能团时,需考虑性质的叠加,有时也需比较活性差异(如本题中胺的碱性强弱比较)。
通过以上对乙醇性质的系统复习及对哌啶乙醇的延伸探讨,可以建立起以官能团为核心、以典型物质为范例的有机化学学习框架,从而能够从容应对各类试题变体。